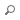Actus DFO - janvier 2025

Sommaire
Denosumab et DFO : un traitement tout en mesure
De plus en plus de preuves démontrent que le facteur pro-ostéoclastique RANKL joue un rôle clé dans la pathogenèse de la dysplasie fibreuse (DFO). L'inhibition de RANKL apparaît ainsi comme une stratégie thérapeutique efficace pour modifier l’évolution de cette maladie rare.
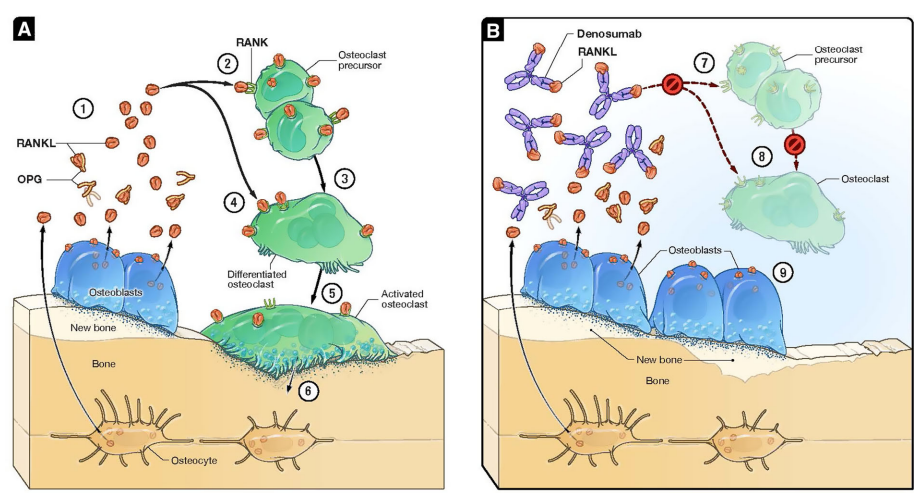
Mécanisme d'action du denosumab. A. En réponse à des stimuli pro-résorption tels que la baisse d'œstrogènes après la ménopause, le RANKL libéré par les ostéoblastes et les ostéocytes entraîne la formation (2, 3) et l'activation (4, 5) des ostéoclastes. L'activation des ostéoclastes entraîne la libération d'enzymes impliquées dans la dégradation des collagènes et d'autres protéines, et une diminution de la masse osseuse (6). Pour supprimer physiologiquement la résorption osseuse, les ostéoclastes produisent une protéine soluble leurre appelée ostéoprotégérine (OPG) qui se lie à RANKL et le neutralise (1), empêchant ainsi RANKL de se lier au RANK sur les cellules précurseurs et les ostéoclastes matures. B. Le denosumab agit de manière similaire à l'OPG et inhibe ainsi le développement des ostéoclastes à partir des cellules précurseurs (7) ainsi que leur fonction et leur survie (8). Cela réduit la libération des enzymes qui dégradent les protéines, favorise le remplissage des cavités par les ostéoblastes et permet à la formation osseuse basée sur le modelage de se poursuivre (9). Figure tirée de David L Kendler et al., 2022.
Une étude précédente de phase 2, menée par les équipes du National Institutes of Health (NIH), a montré que le denosumab administré à haute dose (120 mg par mois avec des doses de charge les semaines 2 et 3) entraînait une réduction marquée de l’activité des lésions, une amélioration fonctionnelle et une augmentation de la minéralisation des lésions. Cependant, cette étude a également révélé des complications potentielles liées à l’arrêt du traitement, notamment une hypercalcémie sévère et une augmentation transitoire du renouvellement osseux, soulignant la nécessité d’explorer des schémas posologiques optimaux.
Dans une nouvelle étude, le groupe NIH a évalué l’efficacité et la sécurité de doses modérées de denosumab (120 mg tous les trois mois) chez six patients adultes atteints de DFO, après une phase initiale de traitement à haute dose. Les chercheurs ont analysé les biomarqueurs du remodelage osseux, l’activité des lésions via des PET/CT au fluorure de sodium (18F-NaF) et les caractéristiques histologiques.
Les résultats montrent que les doses modérées de denosumab réduisent efficacement l’activité des lésions et les biomarqueurs osseux, tout en maintenant une amélioration de la minéralisation des lésions et une diminution de la cellularité fibrotique. Ces effets, comparables à ceux observés avec les doses élevées, indiquent que des doses modérées pourraient limiter les risques d’effets indésirables tout en préservant l’efficacité thérapeutique. Cependant, deux patients présentant une charge pathologique importante ont montré des rebonds d’activité osseuse entre les doses, soulignant la nécessité d’un ajustement personnalisé du traitement.
Cette étude suggère que le denosumab, à doses adaptées, pourrait devenir une option thérapeutique clé pour les patients atteints de DFO. Des recherches complémentaires sont nécessaires pour affiner les protocoles de traitement, maximiser les bénéfices cliniques, tout en minimisant les complications.
Pour en savoir + : Safety and Efficacy of Moderate-Dose Denosumab in Fibrous Dysplasia: Observational Results from a Phase 2 Clinical Trial.
Szymczuk V, Elbashir II, Ahmed R, de Castro LF, Milligan K, Li X, Saboury B, Boyce AM.J Clin Endocrinol Metab. 2024 Dec 13:dgae867. doi: 10.1210/clinem/dgae867.
FAPα : un nouveau biomarqueur pour mieux comprendre et traiter la DFO
Une étude récente, publiée dans Cells, met en lumière le rôle du Fibroblast Activation Protein-alpha (FAPα) dans la dysplasie fibreuse des os (DFO), une maladie osseuse rare due à des mutations du gène GNAS.
Qu’est-ce que FAPα ?
La protéine d'activation des fibroblastes (FAPα) est une sérine protéase membranaire impliquée dans la dégradation de la matrice extracellulaire. Initialement identifiée dans le stroma des tumeurs solides, elle est exprimée par les fibroblastes associés aux carcinomes. Naturellement clivée et libérée dans la circulation, son expression est relativement limitée aux processus pathologiques fibrotiques, ce qui en fait un biomarqueur circulant et une cible thérapeutique prometteuse pour de nombreuses maladies impliquant fibrose et inflammation.
FAPα a déjà été explorée comme cible dans les cancers, où des petites molécules et des anticorps monoclonaux dirigés contre elle ont été développés. Bien que ces approches n’aient pas significativement amélioré la progression tumorale, FAPα s’est révélée utile en imagerie médicale grâce à des radiotraceurs spécifiques (68Ga-FAPI, 18F-FAPI).
De plus, elle est considérée comme un activateur potentiel pour des pro-médicaments ciblés en raison de sa spécificité pour les tissus fibrotiques pathologiques.
FAPα dans la dysplasie fibreuse : une découverte prometteuse
Les chercheurs ont trouvé que les niveaux de FAPα sont plus élevés chez les personnes atteintes de DFO et qu’ils augmentent avec la gravité des lésions osseuses. Cela signifie que FAPα pourrait être utilisé pour mieux suivre la progression de la maladie et adapter les traitements en conséquence.
L’étude a également montré que des traitements anti-RANKL, comme le denosumab, peuvent réduire les niveaux de FAPα, ce qui pourrait indiquer un impact positif sur l’activité de la maladie. À l’avenir, FAPα pourrait également devenir une cible pour de nouveaux traitements plus précis, limitant les effets secondaires des thérapies actuelles.
Des perspectives pour les patients
Cette découverte offre deux avancées importantes : son utilisation comme biomarqueur permettrait un suivi plus précis de la progression de la maladie et une meilleure adaptation des traitements. De plus, en tant que cible thérapeutique, FAPα ouvre la voie à des stratégies innovantes, comme le développement de pro-médicaments activés localement, qui pourraient réduire les effets secondaires systémiques des traitements actuels.
Pour en savoir + : Fibroblast Activation Protein Is Expressed by Altered Osteoprogenitors and Associated to Disease Burden in Fibrous Dysplasia.
Raborn LN, Michel Z, Collins MT, Boyce AM, de Castro LF.Cells. 2024 Aug 27;13(17):1434. doi: 10.3390/cells13171434.
L’autotaxine, une nouvelle cible dans la DFO ?
La dysplasie fibreuse des os (DFO) est une maladie rare qui affecte le développement et la structure des os. Elle est causée par une mutation du gène GNAS, qui perturbe un mécanisme cellulaire crucial, appelé voie de signalisation Gαs. Cette anomalie entraîne une production excessive d’une molécule appelée AMPc (adénosine monophosphate cyclique), responsable de dysfonctionnements dans les cellules osseuses et de la formation de lésions osseuses caractéristiques. Actuellement, il n’existe pas de traitement curatif pour cette maladie, ce qui rend les recherches sur de nouvelles approches thérapeutiques essentielles.
Qu’est-ce que l’autotaxine (ATX) ?
L’autotaxine (ATX) est une protéine produite par des cellules osseuses spécialisées : les ostéoblastes (responsables de la formation osseuse) et les ostéoclastes (impliqués dans la résorption osseuse). Cette protéine joue un rôle clé dans le maintien de l’équilibre osseux. Elle agit en transformant une molécule appelée lysophosphatidyl-choline (LPC) en acide lysophosphatidique (LPA), une substance qui influence la formation et la régénération des os.
Les recherches ont montré que la production d’ATX est stimulée par la voie de signalisation Gαs et par l’AMPc. Par ailleurs, une hormone importante pour la santé des os, la parathormone (PTH), active également cette voie et semble favoriser la production d’ATX. Cela suggère un lien entre ces mécanismes et les anomalies observées dans la DFO.
Dans une étude appelée GNAS-AUTAX, les chercheurs ont étudié le rôle de l’ATX dans la DFO, en utilisant des modèles expérimentaux (cellules et souris) ainsi que des échantillons provenant de patients. Les résultats sont les suivants :
- Modèles cellulaires et animaux : les cellules osseuses activées par la voie Gαs produisent davantage d’ATX, et des niveaux élevés d’ATX ont été détectés dans les lésions osseuses de souris atteintes de DFO.
- Patients humains : chez les patients atteints de DFO, l’expression d’ATX était significativement augmentée dans les cellules osseuses issues des lésions par rapport aux témoins. Cependant, les niveaux d’ATX mesurés dans le sang des patients étaient similaires à ceux des témoins, indiquant que cette protéine agit principalement au niveau local dans les os.
- Lien avec la PTH : chez les enfants atteints de DFO, une association a été observée entre les niveaux d’ATX et ceux de PTH, renforçant l’hypothèse d’un lien entre cette hormone et l’activité de l’ATX.
Perspectives thérapeutiques
Les résultats de cette étude suggèrent que l’ATX pourrait être une cible thérapeutique prometteuse pour la DFO. En agissant sur cette protéine ou sur la voie de signalisation qui la stimule, il pourrait être possible de ralentir ou de limiter les lésions osseuses. Par ailleurs, la découverte de la présence de mastocytes (un type de cellule immunitaire) dans les lésions osseuses des patients ouvre une autre piste de recherche pour mieux comprendre et traiter la maladie.
Pour en savoir + : M. Legrand et al. L’autotaxine, une nouvelle cible dans la dysplasie fibreuse des os ? Revue du Rhumatisme. Volume 91, Supplement 1, December 2024, Page A106.